多方關注的《再生醫療三法》目前正在行政院審查,力拚今年送立法院審議。為了加快審查速度,將從「再生醫療三法」簡化為「再生醫療二法」,新法將有助於細胞治療走向製劑發展階段,降低細胞治療的成本、擺脫富人醫療的批評,並有條件許可第二期製劑,加快運用在急迫的病人身上,縮短臨床治療的應用時間。
圖片來源:Pixabay
自2018年《特管辦法》納入細胞治療技術後,累積至今年9月底,全台共核准170件治療計畫、受惠病患約800人。細胞治療在台灣尚未發展成熟,《特管法》開放的是患者取出自己的細胞培養「自體細胞」治療,治療費用成本仍比外國高,被批為「富人醫療」。根據統計,再生醫療療程的平均花費為新台幣180萬元,是多數病患無法負擔的天價藥費,思考再生醫療如何平民普及化,對病患是一大福音,也是再生醫療當前的一大挑戰。為鼓勵細胞治療發展與提升國際競爭力,行政院今年提出再生醫療三法草案,其中包括《再生醫療發展法》草案、《再生醫療施行管理條例》草案、《再生醫療製劑管理條例》草案,讓細胞治療走向製劑發展階段,才能大量生產細胞治療藥品降低價格。
再生醫療法原本是規劃三個法案,其中比較重要的是《再生醫療管理條例》與《再生醫療製劑管理條例》,而母法《再生醫療發展法》算是基本法,由於政府已經通過《生技醫藥產業發展條例》的賦稅優惠和獎勵辦法,並將再生醫療等新興產業納入,為避免疊床架屋決定取消《再生醫療發展法》,將「再生醫療三法」簡化為「再生醫療二法」。再生醫療法目前正在行政院審查,預計10月就會審查完畢,衛福部次長石崇良6日表示,絕對有機會送立法院本會期審議。
經濟部委託資策會科技法律研究所近日舉辦《2022年精準健康跨域發展座談會》,探討再生醫療政策變化對產業的影響,曾任台灣東洋藥品8年法務長的普華商務法律事務所合夥律師林金榮,以法律人身份分享在生醫產業界的多年經驗。林金榮解釋,《再生醫療施行管理條例》前身為特管辦法,乃「醫療法」之特別法,用來管理治療範圍及業者、醫院、實驗室等執行單位;而《再生醫療製劑管理條例》是「藥事法」的特別法,管的是藥劑和產品,依法發予販賣製造業者製劑許可證,針對再生醫療產品的上市管理、藥害救濟、細胞合適性判定、細胞管理、再生醫療技術施行等產品與執行層面進行專業規範。
圖一、「再生醫療」三法及產業版圖
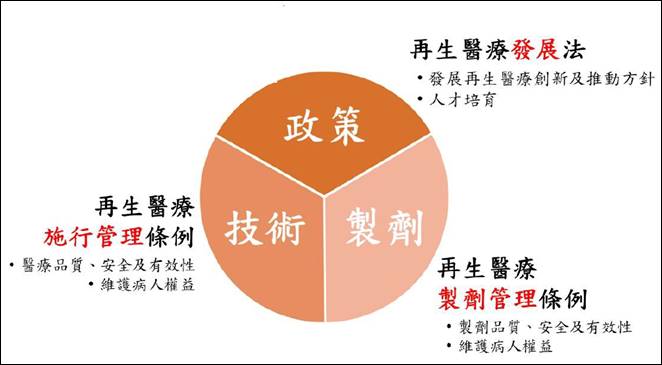
圖片來源:台北醫學大學衛生福利政策研究中心
再生醫療修法釋出三大產業利多
林金榮認為,這次再生醫療修法通過後,將帶動再生醫療產業興盛,因為修法將釋出三大利多,首先是設立再生醫療基金,財源以規費為大宗,每年預估可注入上百萬甚至千萬元經費;其次是針對製造困難的細胞,將可由國家級細胞庫提供給學研界、產業界培養使用;第三項利多是減少研發時間,以往傳統藥物要經過三期試驗,做完都超過15年,現在針對部分特定疾病項目,只需第二期臨床實驗完,可有條件核予許可證,也許五年就可提早上市,促進產業大幅度開發、或是讓生技公司協助醫療機構進行細胞製成,縮短臨床治療應用時間。林金榮強調,許多病人的治療有急迫性,若是等到再生劑完成第三期臨床試驗時間會很長,《再生醫療製劑管理條例》第8條有條件許可第二期製劑,在推估安全性與初步療效的情況下給予有條件許可,可縮短藥品上市時程、及早應用到病人身上。以往必須完成三期臨床試驗和符合GTP、GMP的藥廠才能製造相關藥物,未來此條例三讀通過後,在有條件許可下,藥廠就可以透過募資、設廠,引進國外相關技術。
林金榮指出,目前細胞治療多數仍用在癌症整治上,但可應用的疾病治療也逐步增多,例如利用幹細胞藥品可用治療急性心肌梗塞、腦中風,或用來修復受損的脊髓細胞、肺部細胞等,近來細胞治療的修復功用亦被運用在新冠疫情患者的治療上,目前已有初步的成效,台灣生醫廠商可以思考透過商業供購或投資取得相關產品或技術。隨著細胞治療、基因治療市場的發光發熱,促使「委託設計製造」模式(CDMO)的生醫公司也跟著受到市場關注,台灣近期進行CDMO廠投資、合資或募資的案件增多,顯示有愈來愈多的廠商投入CDMO產業,近期通過的《生技醫藥產業發展條例》也將CDMO納入業優惠的適用範圍,作為生醫產業發展的一個重要方向,期望能提升台灣業者在全球生醫產業供應鏈的重要性。
《再生醫療施行及管理條例》隱藏的玄機
永曜法律事務所主持律師蕭維德曾參與再生醫療法案起草,並在會中分享《再生醫療施行及管理條例》背後隱藏的玄機。蕭維德認為,這次新法攸關產業發展最重要的是《再生醫療施行及管理條例》第15條,特別設計了彈性之處,原本醫療機構施行再生醫療前,必須進行人體試驗,但此條規定使用取得中央主管機關許可證或附有附款許可之再生製劑、施行第4條中央主管機關核准之再生技術、施行其他經中央主管機關公告之再生醫療不在此限。但醫療機構並非拿著FDA核准的再生製劑就可以使用,還要跟向中央主管機關衛福部申請核准使用再生製劑或再生技術,但衛福部希望權力可以下放,未來將可委任委託其他機關構、法人、團體辦理。
另一項重點在《再生醫療施行及管理條例》草案第5條,有條件開放醫療機構得施行再生技術,免依再生醫療製劑管理條例之規定,申請再生製劑許可證或附款許可。蕭維德指出,醫療機構如果掌握足夠的研究能量,當技術已達到相關標準、計畫被核准時,將可繞過再生醫療製劑必須取得食藥署上市許可的程序,直接使用還未正式上市的相關再生醫療產品,以施行再生技術的方式與名義,直接於醫療機構全面施行該項再生醫療。本項修法賦予醫療機構很大的發展空間,因此醫院將會需要外部技術、資金、能量、設備的支援,並與生技公司、實驗室與細胞製備場所機構,預期將產生大量產業合作之商機。
另外一個打開彈性之門是在《再生醫療施行及管理條例》草案第7條,正式賦予醫療機構及生技醫藥公司自設實驗室或細胞製備場所(CPU)進行細胞操作之法源依據,並授權醫療機構及生技醫藥公司不必取得藥商執照, 就可以執行。新法未來將採高規格管理細胞製備場所,必須符合GDP、GMP、DDP GTP等規範。以後醫療機構的實驗室、及生技醫藥公司都可以接受其他醫療機構委託執行細胞操作,意即允許對外提供細胞操作的商業服務。
天明製藥生醫部法規臨床經理楊淑茸則表示,台灣罹患癌症比率仍是三大死因之一,目前開放細胞治療技術受惠不少患者,惟癌症用藥技術越來越成熟,免疫細胞治療如何在合適的時機併入常規治療,是生技公司與臨床醫師需要實際銜接多做溝通之處。如未來主管機關能評鑑出通過供應商名單查詢,讓原物料與設備來源更透明化,加速實驗室生產合規的製品。
資料來源:
- 2022/10/4,111年精準健康跨域發展座談會「場次二主題:再生醫療與精準健康整合前瞻:從法規鬆綁到產業化」大會手冊。
| 作者: |
吳碧娥 |
| 現任: |
北美智權報主編 |
| 學歷: |
政治大學新聞研究所 |
| 經歷: |
北美智權報資深編輯
驊訊電子總經理室特助
經濟日報財經組記者
東森購物總經理室經營企劃 |
|
|
|
| Facebook |
|
在北美智權報粉絲團上追踪我們 |
     |
|
|
|
|
|
|
|

