以全球生技產業發展近況來看, 2007 年全球製藥產業市場規模已達 7,120 億美元,其中美國產值即高達 3,045 億美元,亞洲國家(不含日本)則是呈現快速成長的態勢,成長率達 13.1% ;此外,當年度全球醫療器材市場規模也有 1,940 億美元,而市場也預估 2006-2011 年平均成長率將達 6.1% 。
反觀台灣生技產業的發展近況, 2007 年時,產值最大的製藥產業產值約 新台幣 568 億元,而醫療器材產業由於以生產居家用消費型產品為主,產值約 新台幣 515 億元,全球市佔率僅約 1% ;新興生技產業產值最低,僅約 226 億元,三大產業產值總計僅約 新台幣 1,300 億元,民間投資也自 2001 年開始突破 200 億元後出現成長停滯的現象, 2008 年也僅有 新台幣 250 億元。
若就製藥產業而言,藥物開發過程需付出相當高金額與時間成本,特別是臨床試驗階段,除高成本的金錢及時間支出外,更需具有能承擔高風險失敗的能力。以台灣廠商而言,在藥物開發定位上,如能定位在臨床一期或臨床前試驗的加值研發單位,藉由其相關實驗、研究所得明顯具功效的數據,提高競爭性吸引授權,便可在最低支出成本下獲得最大效益而提高其價值;因此,以下除簡單說明製藥產業特性(藥物開發流程)外,特別針對 2001-2005 年全球生技製藥產業授權狀況,簡單作一分析以了解其產業策略發展概況。
根據 PhRMA 的資料指出,一個新藥從發現( Discovery )、進行一系列的臨床前( Preclinical )、臨床試驗( Clinical Trials ),到最後成功上市( Approval ),需花費 10-15 年時間,更需花費 8-10 億美元的成本,開發的 5,000-10,000 個化合物( Compound )中,到最後僅有 1 項藥品能通過試驗而上市 〈參考文獻 2 〉。
|
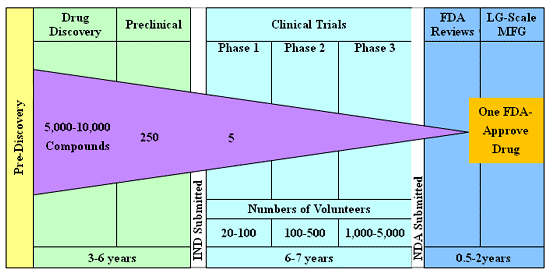 |
註: IND- Investigational New Drug Application ; NDA- New Drug Application |
| 資料來源: PhRMA |
在臨床試驗上(參考文獻 3) ,每階段的臨床試驗都有其主要目的與成功機率,由 phase I (臨床一期) 至 phase III (臨床三期) ,簡單地說,主要分別進行安全性評估 (Safety) 、有效性評估 (Effectiveness) 及綜合暨適當劑量評估 (Proper dosage) 等,依治療標地或原料來源等,試驗時間及成功率都有相當大幅度地不同,花費上當然也有所不同,平均來看,進入臨床試驗藥物能通過臨床三階段試驗者僅約 5% (後續核准後審查於此不加以討論)。
表2 美國食品與藥品管理局(FDA)各階段新藥試驗通過機率統計 |
Phase |
Length of study |
What researchers are studying |
Success rate |
Phase I |
Several months |
Safety |
70% |
Phase II |
As long as two years |
Effectiveness |
33% |
Phase III |
One-four years |
Safety, effectiveness
and proper dosage
|
25-30% |
資料來源: MayoClinic
由前可知,製藥產業在研發過程中,其不確定性因素明顯較其他產業來得高,除需面對最基本問題,也就是療效問題外,最重要地,還是需對於人體無嚴重甚至完全無副作用等。
就藥廠而言,如何選擇一適當且具市場潛力的藥物便是首先要面對的問題(於此無討論孤兒藥狀況),另外,由前可知,隨著藥物開發愈到後端階段,在成功率比例不斷提高因素下,當然其上市機會愈大,價值便愈高。因此,觀察 2001-2005 年生技業者在各階段授權狀況,大致來看,藥物授權似乎也越來越傾向在 Phase II 之後,在 2001 年以前不到 20% 的狀況下,到 2004 及 2005 年,則已經達到約 30%;另外,在 Preclinical 及 Phase I 階段者也大致相同,比例上都有明顯的增加;相反地,於研發階段即授權的比例在發展上,似乎有趨於保守的狀況,授權的策略上似乎有了微妙地變化。
|
|
| 資料來源: Pharmaceutical Licensing Strategies |
若再進一步觀察前 10 大藥廠(Pfizer, Sanofi-Aventis, GlaxoSmithKline, AstraZeneca, Johnson & Johnson, Roche, Merck & Co., Novartis, Wyeth 及 Bristol-Myers Squibb 等) 2001-2005 年授權次 數及金額也可以發現,授權金額在 2002 年之後有相當明顯提升, 2002-2005 年,平均授權金額分別達到 1 億 4,900 萬、 1 億 7,000 萬、 1 億 8,700 萬及 2 億 6,600 萬美元,分別成長 14 、 10 及 42% ,都有超過 10% 的成長(特別是 2005 年),推測與授權階段延後也有相當關係,也顯示藥廠在授權評估策略上,似乎愈來愈傾向以已有初步實驗成果的技術或產品進行評估,雖所必須支付的金額較高,但卻可免去先期投入支出且後續產品推出、上市的時間能大幅縮短,就長遠來看,不失為良好策略。
圖2 2001-2005年前10大藥廠授權次數及平均金額 |
|
| 資料來源:Pharmaceutical Licensing Strategies |
依據第 1084 期(2008 年 9 月)商業周刊譯自美國霸榮《 BARRON'S 》週刊 2008 年 8 月 18 日 封面故事《 Browsing in the Biotech Aisle 》內容指出(參考文獻 4),多家大型藥廠如輝瑞、羅氏、默克等,為引進新的「營收金雞母」,均鎖定具研發能力的小型研發藥廠進行併購。
對大型製藥公司或大型生物科技公司而言,明星專利藥到期,營收預期將大幅降低,為目前最嚴重問題;因此,以併購或授權取得可短期內進入市場的創新專利藥亦是目前大藥廠的主要的產品開發策略之一。台灣生技業者在資金及臨床經驗相較不足的狀況下,如能活絡藥品開發技術(智財、Know-How 等)應用,建立與大藥廠的互動機制,充分結合其優勢,在製藥產業內建立自己的利基,將更有充份地發展空間。
■參考文獻
|