截至2015年底,大陸擁有5,065家藥品生產企業,是全球最大的原料藥生産國和出口國,同時也是全球最大的製劑生産國,但其中高達97%的產品為仿製藥,藥品同質化嚴重,重複生產加上低水平問題突長期存在。大陸藥品生產行業集中度低,藥品流通環節多、流通秩序混亂,由此更衍生出掛靠經營、商業賄賂屢禁不止等亂象,在藥品價格推升下,不良藥品企業甚至會誘導醫生開大處方、開貴藥,對國家和個人都造成很大的損失,大陸醫藥領域確實已到了需要全面改革創新的時候!
根據大陸近期發布的過度重複藥品公告顯示,大陸同時有超過100家藥廠同時生産的藥品多達129種;另一方面,大陸藥品批發企業超過1.3萬家、零售企業45.3萬多家,前三大藥品批發企業市場占有率僅爲33%,與已開發國家普遍八成以上的占有率相差甚遠[1]。
為了追求市場效益,大陸一些藥品生產企業不斷擴大藥劑生產的品種,或是建設新的生產線,造成藥品生產重複、生產設備閒置率過高,營造出藥品生產市場繁榮的假象。其中更有少數企業以劑型、包裝、規格等不同為由,重複申報批准文號,造成藥品上市許可泛濫,2015年8月,大陸國務院印發44號文《關于改革藥品醫療器械審評審批制度的意見》,揭開了深化大陸藥品監管制度改革的大幕。此輪改革的目的不僅在於解决審評審批積壓、申報資料質量不高、仿製藥質量不高等實際問題,還要建立起一個科學、有效和完善的藥品監管體制。在大陸政府推行的這一套監管體制中,「藥品上市許可持有人制度」可謂最重要的支柱。
大陸藥品註冊將推行「藥品上市許可持有人制度」
藥品上市許可持有人制度是歐洲、美國、日本等製藥先進國家監管藥品的通行做法,藉由「藥品上市許可」與「生産許可」分離的管理模式,允許藥品上市許可持有人(包括藥品生產企業、研發機構或者科研人員)自行生產藥品,或是委託其他企業生產藥品。而大陸過去採取上市許可與生産許可合一的管理模式,僅允許藥品生産企業在取得藥品批准文號,獲得認證並生產該藥品,也就是說,藥品上市許可只頒發給具有《藥品生産許可證》的生産企業,藥品研發機構、科研人員不具備獨立獲取藥品上市許可的資格,新藥研發機構獲得新藥證書後只能將相關藥品技術轉讓給藥品生産企業,這種「捆綁」模式不利於鼓勵新藥創新。
過去大陸製藥市場經濟秩序尚未建立、大部分製藥廠商以生産仿製藥爲主,政府進行註冊和監管有其必要性,但隨著大陸一定的合理性。但隨著大陸醫藥産業創新能力的提升,這種捆綁制的管理方式將會成爲大陸藥品產業發展的阻礙。
2016年6月6日,國務院辦公廳國務院於正式發布印發《藥品上市許可持有人制度試點方案》,在北京、天津、河北、上海、江蘇、浙江、福建、山東、廣東、四川這10省(市)展開藥品上市許可持有人制度試點工作,允許藥品研發機構和科研人員取得藥品批准文號,對藥品質量承擔相應責任,試點將實施至2018年11月4日。藥品上市許可持有人制度的實施,意味著大陸藥品監管體制改革的重頭戲業已登臺。通過試點的方式先驗證其科學性和可行性,未來將成爲大陸《藥品管理法》的核心制度之一,進而在大陸藥品市場全面推廣實施。
表一、藥品上市許可持有人試點品種申報情况表
省份 |
臨床試驗申請 |
上市申請 |
補充申請 |
合計 |
北京 |
0 |
4 |
0 |
4 |
天津 |
0 |
1 |
0 |
1 |
河北 |
0 |
0 |
1 |
1 |
上海 |
1 |
9 |
15 |
25 |
江蘇 |
29 |
9 |
0 |
38 |
浙江 |
7 |
9 |
1 |
17 |
福建 |
0 |
0 |
2 |
2 |
山東 |
17 |
2 |
4 |
23 |
廣東 |
39 |
8 |
0 |
47 |
四川 |
4 |
2 |
1 |
7 |
合計 |
97 |
44 |
24 |
165 |
資料來源:大陸食品藥品監管總局(截至2016年12月25日)
藥品上市許可和生產許可分離的管理模式,有助於研發者獲得和集中資金、技術和人力進行持續研究和新藥研發。由於藥品從研發到獲取批准文號需要很長的週期,若在過程中出現問題,那麼此前投入的生產線就會變成一種浪費。新制讓研發者能透過技術轉讓、委託生產或其他形式生產藥品,提高設備利用率,亦有助於改變中國藥品研發投入不足的被動局面。
三大環節 改革大陸藥品生産流通使用
近日,大陸國務院辦公廳正式公布《關于進一步改革完善藥品生産流通使用政策的若干意見》,將實施以重大新藥為專項的國家科技計劃,以政府力量扶植持符合條件的藥品企業和科研單位所研發的新藥及關鍵技術,目的在提升大陸生產藥物創新能力和質量療效,顛覆過去以仿製藥為主的市場,促進形成一批臨床價值和質量水平高的品牌藥。
為了加强大陸藥品生產業的技術創新,《若干意見》從藥品生産、流通、使用三個環節提出改革意見。
生產環節方面,首先是嚴格進行藥品上市的審評審批,優化審評審批程序、加快臨床急需的新藥和短缺藥品審評審批。其次是加快推進已上市仿製藥質量和療效一致性評價,對於通過一致性評價的藥品,在採購、使用、醫保支付等方面給予政策支持。除了推動上市許可持有人制度鼓勵新藥研發,同時也加强藥品生産質量安全監管。
流通環節方面,將推動藥品流通企業的轉型升級與併購重組,打破醫藥產品市場分割與地方保護制度;為減少流通環節,推動藥品購銷「兩票制」、淘汰不合規範的企業。此外,大陸政府希望促進醫療機構對於藥品集中採購的參與度,鼓勵跨區域和專科醫院聯合採購。
至於使用環節,首先必須優化調整基本藥物目錄,要求公立醫院優先使用基本藥物、擴大臨床路徑覆蓋面,促進合理用藥;再來是取消藥品加成,調整醫療服務價格,加快建立公立醫院補償新機制,控制醫療費用不合理增長,並改革醫保支付方式,全面推行以按「病種」付費爲主,輔以按人頭付費、按床日付費等複合型付費方式,訂立合理的醫保支付標準。
圖一、大陸《關于進一步改革完善藥品生産流通使用政策的若干意見》醫藥產業結構調整策略
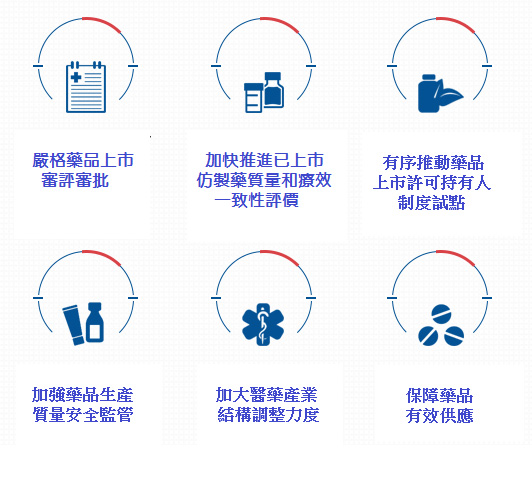
資料來源:中國政府網
值得注意的是,在《若干意見》中,對於專利藥品和已過專利期獨家生産的藥品,大陸未來將採取註冊承諾、藥價談判、集中採購、醫保支付等綜合措施,針對藥價實施動態管理,目標在實現上市銷售價格不高於原產國或大陸周邊可比價格。
為了降低過期專利藥過高的價格,廣東省藥品中心去年首創性地引入「過期專利藥比價系數」規則,即要求過期專利藥與普通GMP組中經濟技術標得分最高的品種進行比價,此舉意在遏制過期專利藥的虛高價格,今年3月2日剛舉辦第一次藥品競價交易正式報價和新低價藥報價工作,今年第一季藥品競價成交總金額超過200億元,平均降價率預計達9.51%,[2]既能減輕大陸醫保資金負擔,也有利於破除市場壟斷,促進大陸本土藥品研發創新。
台灣生技業者認為,大陸醫改最重要的目標是全球的醫藥市場,大陸政府正在動用國家力量進行大規模的醫改,藥物發展的效率和品質將有顯著提升,相關政策的後續發展值得台灣相關業者持續關注。
延伸閱讀:全球醫藥市場變化劇烈 台灣生技產業挑戰大!
備註:
- 2017/2/9中國國家衛生和計劃生育委員會《關于進一步改革完善藥品生産流通使用政策的若干意見》政策解讀。
- 資料來源:2017年03月03日南方日報「遏制過期專利藥虛高價格」。
| 作者: |
吳碧娥 |
| 現任: |
北美智權報資深編輯 |
| 學歷: |
政治大學新聞研究所 |
| 經歷: |
驊訊電子總經理室特助
經濟日報財經組記者
東森購物總經理室經營企劃 |
|
|
|
| Facebook |
|
在北美智權報粉絲團上追踪我們 |
     |
|
|
|
|
|
|
|

